销售服务热线
0574-62101882
Samir M. Parikh
辅酶NAD+是色氨酸代谢产物。研究表明,在小鼠模型中,通过抑制酶解途径中的中间体的降解,可以治疗肾病和肝病。
纵观地球上生命发展史,核苷酸这种小分子扮演者举足轻重的角色。长链核苷酸组成遗传密码,单个核苷酸传递信号或能量。另外,核苷酸的二聚体形式被称为烟酰胺腺嘌呤二核苷酸(NAD+),被证实至少有两种关键的细胞功能。
一、将电子传送到一种被称为线粒体的细胞器的酶复合物中,能量得到了有效地获取;
二、作为酶的底物,例如去乙酰化酶(Sirtuins),调控多种细胞行为。
在Nature的一篇文章中,Katsyuba 等人1揭示了在细胞水平上,NAD+的作用机制,并证实了增加NAD+如何影响疾病发生发展。
简而言之,细胞中可用的NAD+取决于其生成和消耗之间的平衡。啮齿类动物产生NAD+的主要途径依赖于烟酰胺(NAM)的再循环,这种分子要么被摄取,要么被分解NAD+的酶酶解释放(图1)。还有许多其他的NAD+的合成路线,包括,必需氨基酸色氨酸(Trp)的从头合成途径2。突变破坏了负责将色氨酸转化为NAD+的酶,导致人类多个系统的发育不全3,从而证实了这种从头合成途径的重要性。
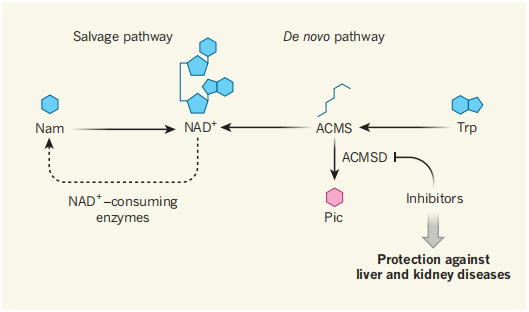
图1:疾病中NAD+的生物合成
辅酶NAD+被酶解生成烟酰胺(Nam)。通过补救合成途径,NAD+循环再生。Nam的补救合成途径被认为是NAD+最主要的合成路线。但,NAD+仍可通过其他很多途径合成。其中一条就是色氨酸的从头合成途径:色氨酸经过多种中间体,最终被转化为NAD+,其中包括ACMS。这一途径可以被ACMS脱羧酶(ACMSD)中断(ACMSD可以将ACMS催化为吡啶甲酸(Pic)。Katsyuba 等人认为在小鼠和线虫体内,通过化学手段抑制ACMSD可以增加NAD+的水平,从而有效改善小鼠的肾病和肝病状况。
Katsyuba等人开始研究α-氨基-β-羧基丁酸-ε-半醛(ACMS),一种研究较少的不稳定的色氨酸途径的中间体。ACMS可以自发的转化为NAD+途径中的下一个中间体,并且可以被ACMS脱羧酶(ACMSD)等一系列酶降解。如此,可以预测,在从头合成中,ACMSD限制NAD+的生成。无论是线虫还是小鼠,ACMSD在进化上都是保守的4。这是一个惊人的发现,因为直到最近,线虫还没有被认可以从头合成NAD+。
该文章作者,抑制了线虫中编码ACMSD的acsd-1基因,从而提高了NAD+的水平。众所周知,增加NAD+可以延长蠕虫的寿命,作者发现,寿命更长的蠕虫,体内的acds-1的表达完全被阻断。另外,抑制acsd-1的表达引起了与抗衰老相关的分子反应5,6:包括增加去乙酰化酶-2.1的活性;增加线粒体功能;保护性的线粒体应激反应。
在人体和小鼠体内,肝脏和肾脏大量表达ACMSD7,最近的研究表明,这些是色氨酸依赖的NAD+产生途径的主要器官8。Katsyuba等人发现抑制Acmsd基因可以提高小鼠肝细胞NAD+的水平和增强线粒体功能。因此,该作者开发了ACMSD的化学抑制剂,并且在小鼠体内,测试了这些抑制剂是否能改善两种衰老相关的疾病:饮食性脂肪肝与急性肾损伤。
有关NAD+的保护性研究早已经被报道9,10,Katsyuba等人的结果证实了增加NAD+在疾病治疗中的潜力——在一些模型中,使用他们的抑制剂可以治疗疾病。研究结果还表明,NAD+的从头合成途径的增加就足以改善与低NAD+水平相关的肝脏和肾脏疾病。然而,要证明这一点,就需要证明ACMSD抑制剂的作用机制是增加NAD+,而不另外的机制,如甲基砒啶酸(由ACMSD介导的ACMs降解产生的)的耗竭。如果得到证实,这一发现将与另外一项研究结果相一致11:该研究在色氨酸通路中发现了一种不同的酶,喹诺酮酸磷酸糖基转移酶,是急性肾损伤易感性的决定因素。
有几个问题值得深入思考。例如,是什么进化压力迫使NAD+的多种生物合成途径的保护机制呢?为什么在涉及到哺乳动物体内的解毒器官,从头合成途径最为活跃? 一种值得注意的可能是,肝脏和肾脏比其他器官更容易受到毒物的侵扰,消耗NAD+。事实上,这些器官把Nam输出到身体的其他部位也许可以解释健康与疾病中器官间的代谢关系——例如,为何慢性肝病患者的大脑和心脏功能经常受损8。
Katsyuba等人开发的ACMSD抑制剂显示了在NAD+增加的临床开发潜力。从第一次NAD+被认为是寿命的决定因素到今已经将近过去了20年12。但是由于衰老的复杂性,很难将其定义。有关增加NAD+与人类寿命间关系的试验太耗时,以至于财政上受限。相反,如果衰老的定义包含了对急性应激源(如感染、创伤或手术)的抵抗力减弱,那么NAD+的临床检测可能变得更加可操作性。最近的另一项研究应用了这一逻辑,报道了一项在接受心脏搭桥手术的人群中进行的口服Nam治疗的试验11(心脏搭桥是一种侵入性手术,常用于老年人,并与术后肾损伤有关)。NAD+的增加保护了急性肾损伤,虽然这只是初步的结果,但阐明了NAD+光明的研究前景。
然而,口服NAD+前体可能不是一种增加NAD+的有效方法8,因此,由Katsyuba及其同事开发的ACMSD抑制剂从理论上讲是有价值的。考虑到肾脏和肝脏中从头合成途径中酶的富集,这种特殊的策略也提出了另一种有趣的思路:组织特异性的增加NAD+。(补充NAD+的有效途径)
对NAD+增加有潜在调节作用的途径是多种多样的,从青光眼13到神经退行性疾病14和代谢综合征15。使用不同的方法(人类遗传学3、放射化学8、比较系统发育1和临床研究11)的一系列研究表明色氨酸通路是NAD+水平的主要调控者和医疗治疗探索的主要方向。
参考文献:
1.Katsyuba, E. et al. Nature https://doi.org/10.1038/ s41586-018-0645-6 (2018).
2.Krehl, W. A., Teply, L. J., Sarma, P. S. & Elvehjem, C. A. Science 101, 489–490 (1945).
3.Shi, H. et al. N. Engl. J. Med. 377, 544–552 (2017).
4.Fukoka, S.-I. et al. J. Biol. Chem. 277, 35162–35167 (2002).
5.Mouchiroud, L. et al. Cell 154, 430–441 (2013).
6.Gomes, A. P. et al. Cell 155, 1624–1638 (2013).
7.Pucci, L., Perozzi, S., Cimadamore, F., Orsomando, G. & Raffaelli, N. FEBS J. 274, 827–840 (2007).
8.Liu, L. et al. Cell Metab. 27, 1067–1080 (2018).
9.Tran, M. T. et al. Nature 531, 528–532 (2016).
10.Gariani, K. et al. Hepatology 63, 1190–1204 (2016). 11.Poyan Mehr, A. et al. Nature Med. 24, 1351–1359.
11.Poyan Mehr, A. et al. Nature Med. 24, 1351–1359 (2018).
12.Lin, S.-J., Defossez, P.-A. & Guarente, L. Science 289, 2126–2128 (2000).
13.Williams, P. A. et al. Science 355, 756–760 (2017).
14.Wang, G. et al. Cell 158, 1324–1334 (2014).
15.Cantó, C. et al. Nature 458, 1056–1060 (2009).